Статья составлена на основе многих других статей на которые будут даны ссылки.
Совсем недавно появился революционный, простой и дешевый способ корректировки генома живых организмов, в том числе и эукариотических, что открывает еще более широкие перспективы по модификации генома в нужную для нас сторону, но одновременно делает вполне реальными те опасности, на которые указывают противники вмешательств в геном живых организмов.
Ссылка: http://ardelfi.livejournal.com/75870.html.
Практически внезапно, с открытием в 2012 году в бактериях генетического аппарата защиты от вирусов, и недолгого периода осознания возможностей, открылась возможность создавать биологическое оружие, превосходящее обычные боевые патогены практически во всём.
При изучении имунной системы бактерий был открыт молекулярный аппарат и метод целенаправленного редактирования ДНК, кратко называемый CRISPR/Cas9, или совсем просто “генетический мотор”. Что нужно знать о нём -- это открываемая им возможность точно и легко вносить желаемые изменения в ДНК целевого организма, которое при достаточном начальном количестве изменённых организмов и кратком жизненном цикле позволяет в результате де факто цепной реакции заменить нормальную ДНК на изменённую во всей популяции за пару поколений. Для организмов вроде насекомых и особенно бактерий это равноценно мгновенной замене популяции натурального организма на популяцию изменённого. Требуемые затраты малы, а эффективность высока.
Есть множество способов использовать эту возможность на благо, но большинство людей точно знает как это будет использовано в первую очередь. Мнения учёных разделились, но равнодушных нет: одни призывают всё засекретить, другие хотят всё всем рассказать. Логически очевидно, что первые не остановят вторых, особенно с учётом уже начавшейся коммерциализации и широко развёрнутых исследований по применению генетических моторов.
Надежда на успешное применение системы CRISPR/Cas9 для решения проблем точного редактирования генома оказалась небезосновательной. Найденные у бактерий и архей в 1987 году непонятно для чего предназначенные кластеры повторов (CRISPR) недаром привлекли внимание исследователей: через 20 лет, изучая бактериальные штаммы для изготовления разного рода заквасок, ученые показали, что система CRISPR/Cas9 защищает бактерий от вирусов. И стали успешно применять ее для своих целей — редактирования геномов всех типов живых организмов. Эта штука была так удобна, проста в применении и эффективна, что не переставала радовать исследователей.
Умные ножницы для ДНК.
Ссылка: http://elementy.ru/lib/432418.

Бактерии и археи не имеют такой иммунной системы, как мы с вами, — это в принципе невозможно, у нас за иммунитет отвечает множество клеток, а бактерия существо одноклеточное. Однако бактерии не беззащитны против вирусов-бактериофагов и других патогенов. Система элементов геномной последовательности, называемая CRISPR, и ассоциированные с ней белки Cas помогают им распознавать и уничтожать чужеродный генетический материал.
В 1987 году в геноме кишечной палочки Escherichia coli был обнаружен загадочный участок, состоящий из многочисленных повторов. Функция этого участка, названного CRISPR-локусом (произносится «криспер»), долгое время оставалась загадочной. Но в 2005 году сразу три группы сообщили, что разделяющие эти повторы промежуточные последовательности зачастую бывают идентичны последовательностям, найденным в геномах бактериофагов и в плазмидах. (Плазмиды — кольцевые молекулы ДНК, путешествующие из одной бактериальной клетки в другую. С их помощью бактерии обмениваются полезными генами, например устойчивости к антибиотикам, но, с другой стороны, некоторые плазмиды обладают чертами «комплекса эгоистичных генов» — используют бактериальную клетку как копирующее устройство, фактически паразитируя на ней.)
Эти данные позволили предположить, что локус CRISPR — часть ранее не известного механизма, который предназначен для защиты бактерий и архей от инфекций. Дальнейшая судьба защитной системы CRISPR/Cas еще интереснее — в 2012–2013 годы на ее основе были изобретены высокоточные инструменты для редактирования генов, а также для управления их активностью. И, судя по всему, это только начало ее карьеры в современной биотехнологии.
Коллекция трофеев
Название локуса CRISPR — фактически его словесный портрет: «скопление разделенных регулярными промежутками коротких симметричных повторов» (clustered regularly interspaced short palindromic repeats). Описание абсолютно верное: короткие повторы чередуются с неповторяющимися последовательностями, как в детском стишке Даниила Хармса: «Чиж-судомойка, чиж-поломойка, чиж-огородник, чиж-водовоз...» — только вместо «чижа» палиндром, одинаково читающийся с обоих концов. В каждом конкретном локусе все повторы практически одинаковы и имеют длину от 24 до 48 пар нуклеотидов. Промежутки также примерно одинаковы по длине (21–72 п. н.), но весьма вариабельны по последовательности.
Так вот, эти промежуточные последовательности, или спейсеры, часто происходят из плазмид и фагов. Бактерии, выжившие после атаки фага, в результате так называемой адаптации пополняют свой CRISPR за счет спейсеров, идентичных небольшим «трофейным» участкам ДНК фага. А значит, спейсерные последовательности массива CRISPR — это память бактерии-хозяина о вирусных инфекциях и встречах с инородным генетическим материалом.
 Рис. 1. Структура локуса CRISPR): а — строение участка CRISPR; б — массив CRISPR и лидерная последовательность; в — те же и «соседи» — гены, кодирующие tracrРНК, и гены белков семейства Cas; г — молекула РНК, возникшая при транскрипции массива CRISPR; как и в самом CRISPR, в ней чередуются повторы и разнообразные участки, комплементарные участкам геномов, нападавших на бактерию плазмид и фагов (по:Molecular Сell, 2010, 37, 7–19)
Рис. 1. Структура локуса CRISPR): а — строение участка CRISPR; б — массив CRISPR и лидерная последовательность; в — те же и «соседи» — гены, кодирующие tracrРНК, и гены белков семейства Cas; г — молекула РНК, возникшая при транскрипции массива CRISPR; как и в самом CRISPR, в ней чередуются повторы и разнообразные участки, комплементарные участкам геномов, нападавших на бактерию плазмид и фагов (по:Molecular Сell, 2010, 37, 7–19)
К локусу CRISPR примыкает лидерная последовательность (длиной до 550 п. н.), а также CRISPR-ассоциированные гены (CAS), кодирующие белки семейства Cas. Лидерная последовательность играет роль промотора — стартовой площадки, с которой начинается транскрипция массива CRISPR, то есть «переписывание» последовательности на РНК (рис. 1). Кроме того, возможно, что лидерная последовательность узнает белки, участвующие во встраивании новых спейсеров: как новые участки ДНК от нападавших микроорганизмов, так и новые повторы обычно встраиваются на границе между ней и CRISPR (рис. 2).
 Рис. 2. Пополнение коллекции фрагментов чужеродной ДНК в системе CRISPR-Cas.
Рис. 2. Пополнение коллекции фрагментов чужеродной ДНК в системе CRISPR-Cas.
После расщепления ДНК фага или плазмиды «трофейный» фрагмент вставляется в локус CRISPR в качестве спейсера. Затем он будет использован как шаблон для создания малых молекул crРНК. С помощью комплексов crРНК и белка Cas9 бактерия защищается от инфекций
Длинная молекула РНК, которая образуется после транскрипции CRISPR, разрезается на фрагменты. Они называются CRISPR РНК (crРНК), причем каждый содержит спейсер и часть повтора. В процессе нарезки участвует небольшая РНК, комплементарная повторам, — tracrРНК: она служит «наводчицей» для белка Cas9, к которому подсоединяется фермент РНКаза III, нарезающий длинную молекулу РНК. Исполнив свою роль, РНКаза III уходит. Остается комплекс двух молекул crРНК и tracrРНК с белком Cas9. Этот белок — нуклеаза, то есть фермент, разрезающий ДНК. Сам по себе Cas9 неактивен, но при связывании с tracrРНК его трехмерная структура изменяется, и он приобретает способность взаимодействовать с ДНК-мишенью — защелкивается на ее двух нитях, превращаясь в нечто подобное замку застежки-«молнии».
А затем комплекс crРНК/tracrРНК-Cas9 начинает расправу с врагом: спейсерные участки crРНК находят комплементарные им участки вражеских нуклеиновых кислот и приносят к ним активированные Cas-белки, те вызывают их расщепление и последующую деградацию. (Этот механизм отчасти напоминает РНК-интерференцию эукариот, см. статью «Вид с вершины» в этом же номере.) Таким образом, crРНК выполняет роль проводника, направляющего нуклеазу к цели, за что она и получила свое другое название: «РНК-гид» (рис. 3).
 Рис. 3. Так образуются комплексы crРНК/tracrРНК-Cas9—оружие иммунной системы прокариот (по: Nature, 2011, 471, 7340, 602–607). Фермент РНКаза III и белок Cas9 распознают tracrРНК, комплементарную последовательностям повторов в цельной молекуле РНК-предшественника (pre-cr РНК). Расщепление, по всей видимости, происходит в середине повтора. Образуются crРНК, каждая из 42-нуклеотидов: 22 «хвостовых» — остаток повтора, остальные 20 — уникальный спейсерный фрагмент, который помогает белку Cas9 искать инородную ДНК
Рис. 3. Так образуются комплексы crРНК/tracrРНК-Cas9—оружие иммунной системы прокариот (по: Nature, 2011, 471, 7340, 602–607). Фермент РНКаза III и белок Cas9 распознают tracrРНК, комплементарную последовательностям повторов в цельной молекуле РНК-предшественника (pre-cr РНК). Расщепление, по всей видимости, происходит в середине повтора. Образуются crРНК, каждая из 42-нуклеотидов: 22 «хвостовых» — остаток повтора, остальные 20 — уникальный спейсерный фрагмент, который помогает белку Cas9 искать инородную ДНК
Чтобы белки Cas узнали и затем расщепили опознанную РНК-гидом последовательность ДНК, непосредственно после сайта-мишени должна находиться короткая (от трех до девяти нуклеотидов) последовательность, называемая PAM — protospacer adjacent motif. Таким образом, атакуются только те участки вражеской ДНК, рядом с которыми находятся эти короткие последовательности. У разных видов бактерий РАМ различаются. Если участок ДНК комплементарен crРНК, но рядом с ним нет РАМ, то комплекс crРНК/tracrРНК-Cas9 его не распознает. У этой особенности есть биологическое объяснение, пока экспериментально не подтвержденное. Дело в том, что в локусе CRISPR наряду со спейсерами, комплементарными инородной ДНК, встречаются и спейсеры, нацеленные на собственную ДНК бактерии. И таких спейсеров-«самоубийц» немало — порядка 20%. Гены эти, однако, не разрушаются, возможно, из-за отсутствия рядом с ними PAM. Роль спейсеров, комплементарных «своей» ДНК, предстоит еще выяснить. Возможно, бактерия с их помощью регулирует не расщепление генов, а их транскрипцию, используя другие белки.
Интересно, что если заразить клетки неизвестным им фагом, то лишь три процента выживших бактерий удлиняют свою CRISPR-кассету на один спейсер, соответствующий новому фагу. Если же клетки заразить фагом, ДНК которого хотя бы отчасти сходна с каким-либо спейсером в CRISPR-кассете, то адаптация идет гораздо активнее. От 50% до 90% популяции пополняет свои CRISPR участками генома этого фага, и выживаемость возрастает в десятки раз. Этот процесс был назван праймингом; не столь уж частый случай, когда в примечаниях к статье можно увидеть московские институты и российские гранты: один из ведущих авторов этой и предыдущей публикации — доктор биологических наук К.В. Северинов). Возможная причина в том, что после опознания белком Cas9 стартовой площадки — PAM — с ДНК-мишенью сначала связывается лишь небольшой участок спейсера (6–12 нуклеотидов), называемый затравкой, и лишь затем остальная часть спейсера. Если на участке затравки комплементарность строго соблюдается, то на остальной части спейсера возможны отклонения, иногда до 3–5 п. н. Бактерии эта неточность на пользу, благодаря ей она может успешно опознать фаги-мутанты и быстро настроиться на поражение новых целей. А вот ученым предстоит разработать методы, повышающие точность распознавания, — в работе «генного скальпеля», о котором пойдет речь дальше, всякую приблизительность необходимо исключить. Возможным выходом может стать использование crРНК с усеченной спейсерной частью.
Напоследок отметим, что у некоторых фагов найдены гены, способные ингибировать систему CRISPR-Cas, и они также весьма интересны в плане практического применения.
Для чего и как используют технологии CRISPR-Cas9
Использование адаптирующейся иммунной системы бактерий началось еще в 2007 году, когда фирма «Дюпон» создала устойчивые к вирусной инфекции бактериальные штаммы для производства продуктов питания (в этих опытах бактерий вакцинировали разрушенными вирусами). Однако подлинный бум начался в конце 2012 года, после того, как Мартин Джинек сумел объединить tracrРНК и crРНК в одну цельную молекулу РНК — теперь ее называют РНК гидом, или sgРНК, от англ. single-guide RNA — и изобрел вектор для клонирования этой РНК.
Оказалось, что такая синтетическая sgРНК образует комплекс с белком Cas9 ничуть не хуже, чем tracrРНК и crРНК, а затем находит комплементарные ДНК и правильно ориентирует Cas9, чтобы создавать в них двухцепочечные разрывы (рис. 4). Причем может сделать это именно в том участке, в каком пожелает исследователь, — достаточно включить в sgРНК фрагмент, комплементарный этому участку. Конечно, выбрать надо такую последовательность, которая встречается только в нужном вам месте и не повторяется там, где разрезы не нужны. Иначе экспериментатор окажется в положении неумелого пользователя, который скомандовал текстовому редактору найти и удалить из рассказа имя «Оля» и с удивлением увидел, что пострадали также «Коля», «поля» и «тополя». После того, как разрез в нужном месте сделан, клетка сама стремится его ликвидировать с помощью процесса, называемого репарацией.
 Рис. 4. Принцип работы Cas9 в природе (с участием crРНК и tracrРНК) и в составе искусственной конструкции, где одна молекула sgРНК заменяет две. Вверху: двухцепочечная ДНК-мишень подвергается точному разрезанию: Cas9 распознает мишень с помощью crРНК, а та удерживается в молекуле Cas9 благодаря посредничеству tracrРНК. Места разрезов обозначены ножницами. RuvC и HNH — домены (части) Cas9; оба они обладают нуклеазной активностью, каждый разрезает одну из двух нитей ДНК. Внизу — тот же процесс с участием цельной молекулы sgРНК, созданной усилиями ученых; она взаимодействует и с Cas9, и с ДНК-мишенью
Рис. 4. Принцип работы Cas9 в природе (с участием crРНК и tracrРНК) и в составе искусственной конструкции, где одна молекула sgРНК заменяет две. Вверху: двухцепочечная ДНК-мишень подвергается точному разрезанию: Cas9 распознает мишень с помощью crРНК, а та удерживается в молекуле Cas9 благодаря посредничеству tracrРНК. Места разрезов обозначены ножницами. RuvC и HNH — домены (части) Cas9; оба они обладают нуклеазной активностью, каждый разрезает одну из двух нитей ДНК. Внизу — тот же процесс с участием цельной молекулы sgРНК, созданной усилиями ученых; она взаимодействует и с Cas9, и с ДНК-мишенью
Как внедрить в клетку высокоточный генный скальпель, состоящий из sgРНК и Cas9? Для этого можно использовать так называемый all-in-one CRISPR-Cas9 cloning vector — кольцевую молекулу ДНК, которая кодирует sgРНК и матричную РНК белка Cas9. Такие векторы, с возможностью вставить в нужное место участок, комплементарный вашей мишени, уже предлагают биотехнологические фирмы. Естественно, кроме кодирующих последовательностей, там будут и управляющие, которые подскажут клетке, откуда надо считывать РНК.
Купив такой вектор и вставив в него «свою» последовательность, исследователь нарабатывает его в необходимом количестве методом молекулярного клонирования. Вектор внедряют в клетки специального лабораторного штамма кишечной палочки, затем растят бактерий на питательной среде, причем они многократно копируют вектор (это и называют молекулярным клонированием). Копируют, но «не читают», sgРНК и Cas9 в бактериальных клетках не синтезируются — командные сигналы в векторе адресованы другому организму. Потом вектор выделяют из бактерий и трансформируют им клетки, геном которых мы хотим отредактировать. Вот в них-то и начнут синтезироваться РНК-гид и Cas9.
Это изобретение генных инженеров еще в начале 2013 года доказало свою эффективность на человеческих клетках в культуре. После инфицирования клетки CRISPR-Cas9-вектором в ней действительно появился комплекс Cas9-sgРНК, который затем проникал в ядро и находил соответствующие последовательности ДНК.
В течение 2013 года технологии CRISPR были опробованы почти на всех модельных видах, используемых в экспериментах. На бактериях комплексы Cas9-sgРНК проявили себя как высокоизбирательный «умный антибиотик» — с их помощью из смешанной культуры бактерий удаляли отдельные виды и штаммы; «скальпель» рассекал специфичные для них последовательности, не трогая остальных. Они показали себя простым и мощным инструментом генной инженерии в опытах с дрожжами, плодовыми мушками, рыбками данио. Появились на свет мыши, обезьяны, свиньи с прицельно выполненными мутациями. Инъекции матричной РНК Cas9 и sgРНК в клетки зародыша позволяют быстро, всего за одну стадию, получить свиней с модифицированным геномом и таким образом создавать модели для изучения генетических заболеваний человека и животных и тестировать на них новые методики лечения. Этот же метод можно применять и для улучшения пород сельскохозяйственных животных и сортов растений.
Программируемые РНК-гидом нуклеазы были использованы для целенаправленного редактирования генома в клетках человека. Понятно, что такая возможность внушает опасения. Но если говорить о реальных, а не фантастических применениях, подобное редактирование — прежде всего мощный инструмент исследования. Например, выключая с помощью CRISPR-Cas9 отдельные гены, можно идентифицировать те, что отвечают за выживание клеток при раке. Более того: обнаружив в отдельных клетках организма мутации, которые ведут к развитию рака, можно будет, используя аналогичные методы, убрать. За короткие сроки была синтезирована огромная библиотека РНК-гидов с различными последовательностями — 73 000 различных sgРНК. С ее помощью можно направлять Cas9 на 80–90% всех последовательностей генома человека.
Резонный вопрос: неужели до 2013 года у молекулярных генетиков не было инструментов для разрезания ДНК в нужной точке? Были, но значительно менее удобные. Например, искусственные ферменты, получаемые путем слияния ДНК-разрезающего домена нуклеазы с ДНК-связывающим доменом другого белка. Для каждой ДНК-мишени приходилось кропотливо конструировать новый фермент. По сравнению с этими конструкциями система CRISPR, где в качестве нуклеазы используется один и тот же Cas9, а менять приходится лишь sgРНК, оказалась намного проще и дешевле. То, на что уходили месяцы и годы труда, удается сделать за неделю.
Напоследок, для тех, кто еще не устал, — несколько слов о других применениях CRISPR-Cas9 (рис. 5). Наряду с обычным «природным» Cas9, который делает двухцепочечные разрывы в ДНК, ученые используют его измененные формы. Первой стоит упомянуть Cas9-никазу — белок, у которого активна только одна из его нуклеаз, а другая инактивирована. Такой фермент делает разрыв только в одной из двух цепей ДНК. Используя парочку таких никаз с разными sgРНК, можно значительно повысить точность генного скальпеля, а кроме того, вырезать большие участки ДНК.
 Рис. 5. Модификации белка Cas9: а — Cas9, у которого активна только одна из его нуклеаз, а другая инактивирована, разрезает только одну нить ДНК, называется Cas9-никазой; б — две Cas9-никазы с разными sgРНК разрезают ДНК с образованием «липких» — одноцепочечных концов; в — мутантный белок dCas9, у которого инактивированы обе нуклеазы, можно использовать для выключения гена, регуляторному участку которого комплементарна sgРНК; г — подобным же образом можно избирательно активировать синтез определенных генов
Рис. 5. Модификации белка Cas9: а — Cas9, у которого активна только одна из его нуклеаз, а другая инактивирована, разрезает только одну нить ДНК, называется Cas9-никазой; б — две Cas9-никазы с разными sgРНК разрезают ДНК с образованием «липких» — одноцепочечных концов; в — мутантный белок dCas9, у которого инактивированы обе нуклеазы, можно использовать для выключения гена, регуляторному участку которого комплементарна sgРНК; г — подобным же образом можно избирательно активировать синтез определенных генов
У мутантного белка dCas9 инактивированы обе нуклеазы. Он находит ДНК-мишень и связывается с ней, но не способен ее разрезать. Казалось бы, какая польза от тупых ножниц? Однако из них можно сделать хороший зажим или прищепку. Белок dCas9 применяют для инактивации генов на стадии транскрипции — он блокирует продвижение РНК-полимеразы, того самого фермента, который синтезирует РНК на матрице ДНК. Этот способ называется CRISPR- интерференцией, или CRISPRi. Аналогичным способом можно не полностью выключать транскрипцию, а избирательно менять ее активность. Для этого к dCas9 добавляют домен белка — фактора транскрипции, который увеличивает или подавляет активность генов, а затем снабжают его sgРНК, которая доставит эту конструкцию на регуляторный участок — промотор нужного гена.
И еще один интересный инструмент — зажим с фонариком. Прикрепив к белку dCas9 зеленый флуоресцентный белок EGFP, можно пометить им определенный участок в хромосоме живой клетки и наблюдать под микроскопом за его судьбой в течение клеточного цикла либо визуально определять длину теломер.
Что впереди?
Крошечная молекулярная машина, защищающая бактерии от вирусов, а также изобретательность и находчивость ученых помогли совершить революцию в генной инженерии, существенно упростив и удешевив технику редактирования геномной ДНК. В перспективе эта технология может значительно ускорить темпы развития экспериментальной биологии и генной терапии, подарит медицине «умные антибиотики»; поможет в проектировании и создании генно-модифицированных сельскохозяйственных животных и растений, а также промышленных микроорганизмов.
Но чтобы сделать технологию безопасной, надо исключить все возможные побочные эффекты — добиться, чтобы комплекс Cas9-sgРНК направлялся именно туда, куда мы хотим его направить, и делал именно то, что от него требуется. Для этого его нужно всесторонне проверить в самых разных условиях и детально прояснить механику его действий. Думается, что возможные применения CRISPR-Cas9-технологии не исчерпаны теми, о которых мы только что рассказали.
Мутагенная цепная реакция: редактирование геномов на грани фантастики.
Ссылка: http://biomolecula.ru/content/1636.
На этот раз всё очень серьезно. Искусственно созданную систему, которая может прицельно вносить изменения в участки генома, научили размножаться. Теперь из гетерозиготных мутантов могут получаться гомозиготные, то есть содержащие эту мутацию в обеих аллелях данного гена. Но самое главное — потомство таких организмов будет почти со 100-процентной вероятностью содержать такую же мутацию. Получается, что исследователи научились вносить изменения в геномы целых популяций! Как же это произошло и как работает?
У бактерий между повторами в CRISPR-кассетах содержатся спейсеры — уникальные участки ДНК, вырезанные когда-то из вторгнувшихся в клетку бактериофагов или плазмид и служащие одновременно «фотороботами» и проводниками CRISPR-ассоциированных (Cas-) белков для оперативного обезвреживания идентичных взломщиков*. При вторжении CRISPR-кассета экспрессируется, длинный транскрипт нарезается на короткие фрагменты (crРНК). Комплементарные соответствующим фрагментам нуклеиновых кислот преступника (протоспейсерам) crРНК «указывают» своим Cas-нуклеазам, кого надо резать. В одной из бактериальных CRISPR/Cas-систем уничтожителем чужеродной ДНК служит белок Cas9 .
* — Работа CRISPR/Cas-систем, рекрутированных биологами в качестве инструментов геномной инженерии, напоминает эукариотическую РНК-интерференцию и обеспечивает прокариотам этакий приобретенный иммунитет, о чём подробно рассказано в обзоре «CRISPR-системы: иммунизация прокариот». — Ред.
Удобство использования стрептококковой системы CRISPR/Cas9 в эукариотических организмах заключается в том, что нужно всего два компонента: «указывающая путь» молекула РНК — РНК-гид (guideRNA, gRNA), комплементарная целевому гену, и фермент Cas9, который расщепляет этот ген (рис. 1). Гены этих двух компонентов помещаются в плазмиду и доставляются в клетку, где должны экспрессироваться. Более того, методика позволяет доставить в клетку сразу несколько РНК-гидов, комплементарных разным генам-мишеням, и фермент Cas9 разрежет их все. Как правило, дляинактивации того или иного гена достаточно внесения двунитевого разрыва. Дальше клеточные ферменты сшивают два конца ДНК, однако такая «починка» (репарация) оказывается неточной. Между «склеивающимися» концами ДНК могут ошибочно встроиться или удалиться отдельные нуклеотиды. В таком случае нарушается правильность «прочтения» транскрипта этого гена при трансляции — происходит сдвиг рамки считывания, изменяется аминокислотная последовательность, синтез белка обрывается на случайно возникающих стоп-кодонах. Такую «медвежью услугу» оказывает разновидность репарации, называемая негомологичным сшиванием концов ДНК (NHEJ, non-homologous end joining).
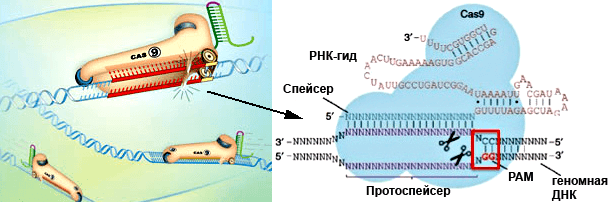
Рисунок 1. Система CRISPR/Cas9 в действии. Фермент Cas9 (изображен в виде конька)разрезает обе цепи геномной ДНК в месте, с которым связывается РНК-гид. РНК-гид (примерно 80 нуклеотидов) состоит из 5’-концевой последовательности (спейсер, 20 нуклеотидов), комплементарной нужному участку ДНК, и «шпильки» (за коньком) для правильной ориентации комплекса. Дизайн РНК-гида должен учитывать один момент, связанный с выбором комплементарной цели. «Целевой» участок геномной ДНК, который будет разрезаться, может быть любым, но за ним должны следовать два цитозиновых нуклеотида, т.к. считается, что РНК-гид лучше связывается с ДНК там, где комплементарная цепь этой ДНК содержит консенсус 5’-NGG-3′ — прилегающий к протоспейсеру мотив, protospacer adjacent motif, PAM. Рисунки из журнала The Scientist и с сайта www.genoway.com.
С помощью CRISPR/Cas9 можно не только нокаутировать ген, но и вставить любой новый участок ДНК вместо старого (например, заменить мутантный на нормальный). Для этого вместе с плазмидой, кодирующей CRISPR/Cas9, в клетку добавляется еще одна плазмида, содержащая ДНК-матрицу («заплатку»), которая будет вставлена при «починке» ДНК. В этом случае с помощью системы гомологичной рекомбинации происходит как бы «заштопывание по шаблону», и нужный ген или его часть оказываются встроенными в ДНК в нужном месте. Матрица для вставки ограничена (фланкирована) участками, комплементарными геномной ДНК с двух сторон от надреза. За счет рекомбинации комплементарных участков вставка матрицы происходит точно в место разреза (рис. 2).
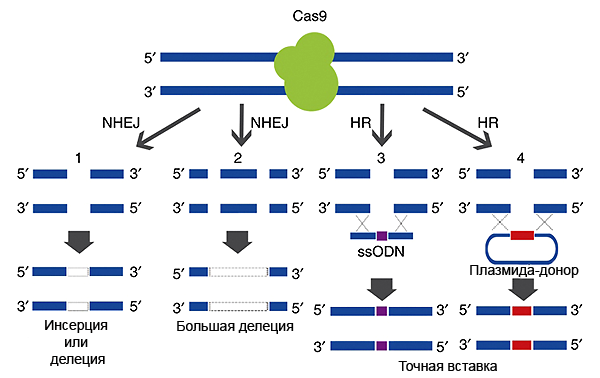
Рисунок 2. Репарация двунитевых разрывов, внесенных комплексом CRISPR/Cas9.Целостность ДНК в районе двунитевых разрывов может восстанавливаться двумя способами. 1)Разорванные концы состыковываются и сшиваются «как получится», при этом могут возникнуть делеции или инсерции (1 и 2). Этот способ называется негомологичным сшиванием концов ДНК (NHEJ). 2) В клетку можно «запустить» еще одну плазмиду или просто одноцепочечную ДНК, содержащую матрицу для репарации — тогда восстановление ДНК будет точным (3 и 4). Такой путь репарации основан на механизме гомологичной рекомбинации (HR), поскольку матрица для репарации — «заплатка» — в плазмиде/одноцепочечном олигонуклеотиде находится между «плечами гомологии» — флангами, комплементарными участкам ДНК с двух сторон от разрыва.
Таким же образом в разрез можно вставить и саму кассету CRISPR/Cas9. Об этом сообщили ученые из Калифорнийского университета — Валентино Ганц и Этан Бьер.
Они «выключали» ген yellow, который отвечает за развитие нормальной окраски туловища — «в темную полосочку» — у Drosophila melanogaster, с помощью системы CRISPR/Cas9. Плазмида, вносящая эту систему в клетку, имела небольшое усовершенствование: кассета CRISPR/Cas9 была фланкирована длинными «плечами гомологии» — последовательностями, комплементарными хромосомной ДНК с двух сторон от предполагаемого разрыва. Такая хитрость позволила ученым не просто внести нокаутирующую мутацию в ген yellow, но и вставить в место разрыва саму кассету CRISPR/Cas9. РНК-гид и фермент Cas9 теперь экспрессировались участками ДНК в составе X-хромосомы и могли разрезáть соседнюю аллель и наследоваться (рис. 3).
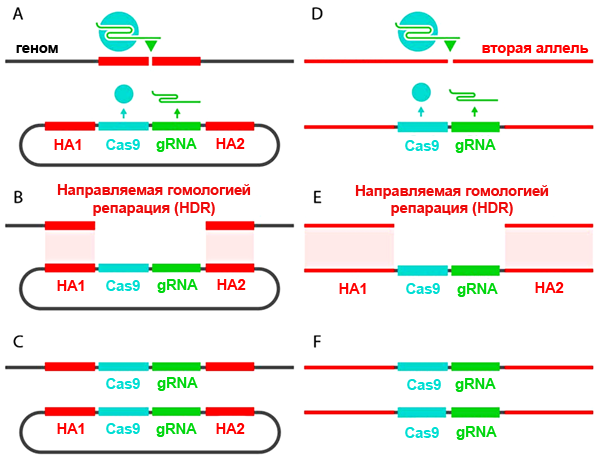
Рисунок 3. «Саморазмножение» кассеты CRISPR/Cas9. А — В плазмиду встроена кассета, содержащая ген нуклеазы Cas9 и матрицу для РНК-гида. Кассета фланкирована участками, гомологичными последовательностям возле места разреза, — плечами гомологии (homology arms, HA1-2). Фермент Cas9 (синий кружок), направляемый РНК-гидом, вносит двунитевой разрыв в геномную ДНК. B-С — Благодаря протяженным (примерно 1000 п.н.) гомологичным участкам происходит рекомбинация, и разрез «застраивается» кассетой CRISPR/Cas9. D-E — Вторая аллель разрезается ферментом Cas9, синтезируемым первой аллелью, и репарируется по тому же принципу. F — Обе аллели изменены: вместо привычной последовательности нуклеотидов встроена кассета CRISPR/Cas9. Ген нокаутирован, инсерция наследуется потомством. Рисунок из статьи, адаптирован.
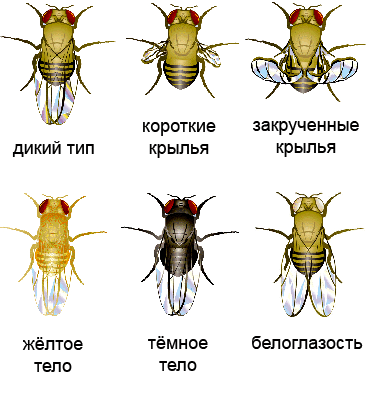
Рисунок 4. Варианты фенотипов при разных мутациях у Drosophila melanogaster. Рисунок с сайта The wonderful fruit fly, адаптирован.
Плазмиду вводили в эмбриональную клетку дрозофилы, из которой затем развивалась обладательница двух измененных аллелей гена yellow — особь с бледно-желтым телом (рис. 4). При скрещивании таких мух женского пола с носителями нормальных генов по менделевским законам наследования (в приложении к рецессивным мутациям в X-хромосоме) только 50% потомства (самцы) должны были родиться бледно-желтыми. Скрещивание самцов-мутантов с нормальными самками вообще не должно было привести к появлению «обесцвеченных» особей (рис. 5, слева). Каково же было удивление ученых, когда в первом случае почти все мухи (97%) были бледно-желтыми, а во втором — почти все самки (рис. 5, справа). Интегрированная кассета CRISPR/Cas9 по типу цепной реакции распространялась по геномам потомства: комплекс ее продуктов — Cas9 с РНК-гидом — упрямо разрезал полученные от другого родителя нормальные аллели гена yellow, и кассета встраивается в разрез путем гомологичной рекомбинации. Потому ученые и назвали разработанный метод мутагенной цепной реакцией, МЦР (рис. 6). Стоит отметить, что во втором поколении мух помимо бледно-желтых особей обнаружили нескольких особей с мозаичной окраской и нескольких — с окраской дикого типа (рис. 7).
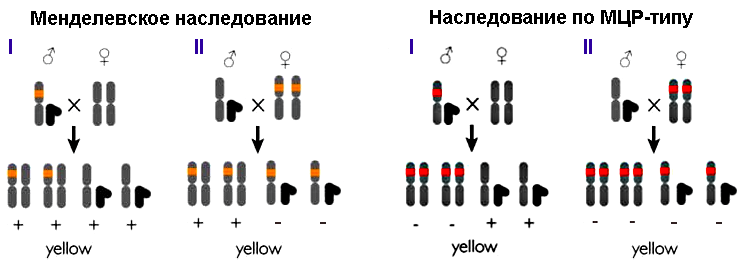
Рисунок 5. Схема распределения аллелей у потомков от скрещивания Drosophila melanogaster дикого типа с особями, несущими рецессивную мутацию в X-хромосоме. Слева — по законам Менделя. Мутация (отмечена оранжевым), возникшая у самца (I), передается только самкам, т.к. потомки-самцы получают нормальную Х-хромосому от матери. Самки-носители одной мутантной хромосомы всё равно будут нормально окрашены (отмечено плюсами): нормальный ген второй хромосомы способен обеспечить особь нужным количеством пигмента. Мутация двух аллелей у самки (II) должна проявиться в фенотипе лишь у 50% потомства (у самцов). Справа — по типу МЦР, мутагенной цепной реакции (при интеграции CRISPR/Cas9). Все мухи женского пола, полученные от самцов-мутантов (I), будут обладать двумя «сломанными» генами yellow (красная метка) и иметь бледно-желтую окраску, т.к. мутация не компенсируется, а наоборот, инсерция CRISPR/Cas9 «саморазмножается», поражая нормальную аллель. Самцы не «бледнеют»: мутантная хромосома им не достается. Мутанты-самки (II) передают по мутантной аллели каждому самцу и каждой самке, у потомков-самцов компенсировать ее нечем, а у самок мутация «перекинется» на нормальную аллель. В итоге всё потомство будет светлым. Рисунок , адаптирован.
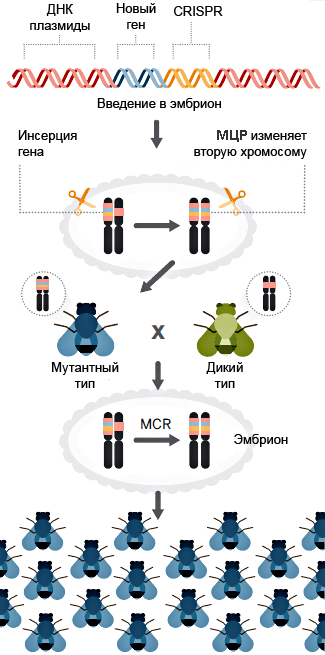
Рисунок 6. Принципиальная схема метода мутагенной цепной реакции (МЦР).В эмбриональную клетку дрозофилы вводится плазмида с кассетой CRISPR/Cas9 и геном устойчивости к какому-либо заболеванию. Этот ген устойчивости вместе с ДНК «мутагенных инструментов» распространяется в клетке на вторую аллель. Взрослеющая особь (синего цвета) становится устойчивой к заболеванию, что само по себе прекрасно. Но, скрещиваясь с обычной дрозофилой, она, вопреки законам наследования, передает ген устойчивости почти всем своим потомкам. Вот так выглядит мечта об оздоровлении целых популяций насекомых. А заодно и нас с вами, если речь идет о болезнях, которые ими переносятся. Рисунок из статьи, адаптирован.

Рисунок 7. Варианты фенотипов по результатам эксперимента. 97% потомков второго поколения были бледно-желтыми, но часть дрозофил имела мозаичную окраску или окраску дикого типа (с темными полосами), что свидетельствует о незначительных сбоях в работе системы CRISPR/Cas9, но никак не умаляет ее эффективности.
Использование такого мощного инструмента может привести к изменению целых популяций живых организмов. Некоторые ученые (и, к слову, миллионы жителей тропиков) буквально мечтали об этом открытии, потому что оно позволит создать комаров, неспособных переносить малярию и лихорадку Денге. Другие рады, что теперь можно быстро выводить линии мышей со множественными мутациями для лабораторных исследований и не тратить время на тщательный скрининг. А там недалеко и до генной терапии.
Однако у многих исследователей мутагенная цепная реакция вызывает большие опасения. Мутация, однажды введенная в геном единственного организма, неконтролируемо распространяется в геномах детей, внуков, правнуков и всех последующих поколений этой популяции. Муха с мутацией в гене yellow, случайно вылетевшая из лаборатории, может внести эту мутацию в природные популяции дрозофил — тогда все плодовые мушки на Земле со временем станут бледно-желтыми, а мы навсегда забудем, как выглядели раньше известные нам Drosophila melanogaster.
А если речь пойдет не о мухах, а о внесении мутаций, например, в геном человека?* Или экспериментаторы совершат ошибки, которые приведут к неконтролируемому распространению страшных патогенных организмов? Ученые успокаивают, что судьба нашей планеты не станет похожа на сюжет фантастического фильма. Они держат своих «бледных» дрозофил за семью печатями: посторонние не имеют доступа ни к пробиркам с плазмидами, ни к экспериментальным мухам. Они разделяют всеобщее волнение по поводу своего открытия, однако очень рады, что придумали такой эффективный метод редактирования генома. То ли еще будет!..
А теперь, осознав уже произошедшее, можно взглянуть на открывающиеся возможности в аспекте причинения вреда. Прежде биологическое оружие было специально созданным организмом, который мог выполнять свою функцию только после попадания в целевой организм, например тело человека. Количество таких организмов (бактерий и вирусов) относительно невелико и они в целом известны, и потому требуемое для защиты от них количество вакцин также относительно невелико. Новая возможность целенаправленно модифицировать любые организмы, включая все виды бактерий и насекомых, расширяет арсенал до неограниченного -- любой модифицированный организм, включая бактерии из человеческого биома, модифицированный для доставки одного или нескольких токсинов, может заменить свой нормальный прототип, заняв его место в экосистеме или человеческом биоме. Сразу есть возможность выбрать организм с важной или незаменимой функцией, который недопустимо просто уничтожить -- например, это могут быть кишечные бактерии (человеческий биом) или пчёлы (опылители для агропроизводства). Также есть возможность выбрать никому не интересный организм или группу организмов, эндемичный для целевой территории, и модифицировать его во вредный или смертоносный для человека или агропроизводства -- этим можно быстро и необратимо уничтожить агропроизводство в целевой экономике, или существенно сократить население целевой территории, не оставляя никаких следов, ведущих к агрессору.
Можно придумать многие тонкие варианты атаки, в том числе постановка целевой территории в жизненную зависимость от лекарств против созданной болезни, и многие другие. Одно лишь не вызывает сомнений: создание стратегического биологического оружия стало доступным даже небольшой биотехнической компании с помощью коммерчески-доступных инструментов и материалов. Это оружие может оставаться абсолютно незаметным до и даже после применения, а динамика его действия позволяет агрессору закончить атаку без риска обнаружения и противодействия.
Вполне можно представить ситуацию, когда в обычную кишечную палочку (лат. Escherichia coli), которая присутствует в большом количестве в организме любого человека, может быть введет например ген одного из самых опасных биологических ядов - бутулотоксина, и через систему мутагенной цепной реакции, через некоторое время, вся популяция Escherichia coli будет являться носителем такого гена и вырабатывать бутулотоксин. Если считать, что между людьми, контактным и воздушно-капельным путем постоянно идет обмен собственной бактериальной флорой, то распространение этого штамма кишечной палочки пройдет по Земле, как лесной пожар, а с накоплением в кишечнике любого человека определенного критического количества таких палочек, бутолотоксин начнет свое действие с практически неизбежным летальным исходом для носителя.
Тогда мечта зеленых - экологически чистая планета, станет реальностью, правда эта Земля будет лишена птиц, многих млекопитающих, в том числе и человека.
Надо ясно понимать, что бег по лезвию бритвы, который мы уже по-факту начали, нельзя ни повернуть вспять, ни остановить. Раз уже начали, надо добегать до конца, каким бы он не был. Также стоит напомнить, что щит и меч куют из одного металла.






Комментарии
Спасибо, читнём на досуге не торопясь. Про "мутагенную цепную реакцию", это только в заголовке?
Нет, там в статье про нее все хорошо расписано.
Мда ... Это как раз, тот самый Ящик Пандоры.
Значит на каждую биологическую лабораторию у наших границ - по мегатонному ядренбатону !
Границы для этого не существенны.
Так проблему не решишь.
Надо ковать щит.
ИМХО, слабое место всей этой системы - белок Cas 9. чтобы создать сверхдоминантный аллель, ген этого белка и сам белок должен присутствовать в организме зараженного, и быть там активным. Активный центр фермента штука практически неизменяемая без потери функций, и при этом очень нежная. "Щит" - высокоселективный ингибитор Cas 9, белковый или небелковый, неважно. Пить раствор ингибитора на завтрак, распылять с воздуха над полями и лесами..да что угодно. Ну как вариант - РНК, интерферирующая с геном Cas 9 и выключающая этот ген. С ингибитором, особенно если он небелковой природы, работать проще, но интерферирующую РНК проще сделать. "Гонка вирусов" тоже имеет право на существование, но мне кажется это излишнее усложнение проблемы.
Так вот что имела ввиду Ванга, когда ванговала про "выжженную пустыню вместо Европы где никто не живет".
Т.е. мы выжгли там всю эту заразу... (((
Скорее уж это предсказание.
ПыСы: если мы не разрушим
Карфагензападную цивилизацию - то она атакует нас биологическим оружием. А в обороне, как известно, нет победы.Хорошая статья, сохранил.
С помощью такого "скальпеля" можно будет например вЫрезать и выкинуть из генома бОльшую часть некодирующего "эволюционного хлама" (а это 97% длины ДНК), что очень значительно повысит энергоэффективность организма. В конструировании искусственных "биоргов" тоже пригодится, конечно после того как постигнут сам принцип формообразования многоклеточных и дифференциации клеток тканей.
Теоретически можно, но эту систему только начали изучать.
Аппендикс, было дело, вырезали у новорожденных. А потом оказалось что эта штука вовсе не атавизм и безполезность. Как бы так не оказалось и с "пустыми" генными последовательностями.
Практика - основа познания. Никто не заставляет экспериментировать на человеческих эмбрионах, для этого есть мыши, мухи-дрозофилы и прочая "традиционная" лабораторная живность.
Думаю, в режимных лабораториях ведущих стран мира уже вовсю экспериментируют и с добавлением "теломерного хвоста", и с расширением списка аминокислот (ДНК "умеет" кодировать только 20 протеиногенных, а известно уже более 50)
Я не спорю. Да и не специалист в этом, но описанная в статье технология мне понятна -это грубо говоря как "текстовый редактор" для программиста который до сих пор возился с перфокартами. От "дурака" не застрахована ни одна область знаний и как говорится "всё что мы знаем может и будет использовано против нас"
Это,я думаю, очередной тест человечества на разумность, второй после ядрёнбатона.
Вспомнилось ещё про "древние суеверия", когда боялись попадания волос, ногтей, крови и просто личных вещей в чужие руки. В свете ТАКИХ знаний "суеверия" заиграли новыми красками.
"Эволюционный хлам" нас как минимум защищает от радиации - вероятность повреждения генов падает пропорционально доле ложных целей.
btk, это ОЧЕНЬ плохая идея. Во-первых 80% всей ДНК клетки согласно последним данным транскрибируется, то есть принимает участие в обеспечении жизнедеятельности клетки. Даже некоторые мобильные генетические элементы выполняют регулирование экспрессии генов. А в-вторых, при вырезании значительной длины ДНК повысится в первую очередь скорость клеточных делений. Механизмы репарации ДНК и часть иммунной системы, предупреждающей развитие рака, не справятся с возросшими темпами деления, что приведет к понятным последствиям.
Если можно - об этом поподробнее, пожалуйста. Насколько я знаю, только 3% совокупной хромосомной последовательности нуклеотидов кодируют белки и прочие необходимые для жизнедеятельности клетки соединения. Остальные 97% - случайный набор знаков, бесполезно удлиняющий хромосому. Каким образом они трансрибируются, если промоторы находятся только в началах белковых последовательностей?
Для того чтобы ответить на ваш вопрос, необходимо пояснить, что "промотор" это достаточно условное понятие, так как посадка транскрипционных факторов на ДНК - вероятностный процесс. Наличие тех или иных "промоторных" модулей, коротких последовательностей-сигналов, увеличивает вероятность начала транскрипции с данного участка, но при изменении управляющих воздействий сродство транскрипционных факторов к тем или иным модулям может изменяться. До сих пор никто не может более-менее точно сказать сколько, собственно говоря, промоторных последовательностей в геноме. Биоинформатические алгоритмы постоянно улучшаются, но наилучшие не "эмпирические" методы поиска промоторов выдают ложноотрицательные результаты примерно в 30-40 процентах случаев. Ну и разумеется помимо белковых последовательностей есть много участков, кодирующих тРНК, рибосомальные РНК, регуляторные РНК...и все эти участки обладают промоторами. А ведь еще есть энхансеры, сайленсеры, инсуляторы... Ген может регулироваться последовательностью, находящейся от него на расстоянии свыше 100 000 н. п. Впрочем, данные проекта ENCODE о 80% транскрибирующейся ДНК подвергаются справедливой критике. Но как минимум их никто не обвиняет в подтасовке данных - откуда-то они же это число взяли. Вопросы в основном о методах подсчета. Более осторожные подсчеты говорят о 20-40% критически функционально значимой ДНК. А про скорость клеточных делений все более-менее понятно - S-фаза клеточного цикла по времени лимитирована именно репликацией.
Хм.. о ускорении деления я не подумал. Хотя, если вырезать куски, но на ту же длину наростить теломеры - можно было бы одним махом убить двух зайцев: увеличить энергоэффективность одновременно с увеличением количества возможных клеточных делений. Впрочем, увеличение продолжительности жизни в разы может оказаться ни к чему, если то что говорит Савельев о нейронах - правда (то что в них необратимо накапливаются невыводимые вещества и то что срок нормального функционирования ограничен максимум сотней лет).
Благодарю за "пищу для размышлений", пойду дальше читать и думать.
Тут не только транскрипция и кодирование белковых соединений. "Пустые последовательности" могут выполнять функцию "резонатора" для разных частот, т е нести "волновую" информацию и управлять таким образом возможно даже известными нам процессами. Неучтённый фактор, так сказать.
Вау, адепт волновой генетики. Который день брожу по афтершоку и дергаю всех адептов "нехимических механизмов регуляции" в плохом смысле этого слова - ну объясните мне механизм этих самых волновых регуляций, или хотя бы ссылку на более-менее приличную статью дайте...пока никто не откликнулся.
http://barbarashan.narod.ru/razd2y0.htm
благодарю.
"Вау, адепт волновой генетик"- "нехимических механизмов регуляции" Скажите, а вы точно знаете какой механизм работы скажем у тРНК? Какие процессы заставляют эту молекулу прибывать точно в нужное место? Чистая химия и случайность?
Я не генетик, многого не знаю, но уверен что в живой клетке случайности крайне редки. У нас нет абсолютных знаний законов физики, а клетка эти законы эксплуатирует на все 100.
Парадокс знаний в том, что знания иногда приводят к заблуждениям. К примеру механизм запахов: первая догадка - запахи как ключи попадают в носу в соответствующие замочные скважины , пришли химики и "развенчали", а прошло некоторое время и узнав больше оказалось что химики неправы, а первая догадка куда более близка к истине.
Процесс познания он такой - заводит в тупик на раз-два. Не стоит помечать все ходы, мимо которых прошли как неверные- так в тупике и останетесь. Я не адепт- "волновая генетика" для меня не более чем непроверенный проход лабиринта, он тоже может привести в тупик.
Процесс биосинтеза белка изучен достаточно хорошо и никаких принципиально неразрешимых парадоксов, связанных со скоростью биосинтеза белка, в нем нет. Эффективность и скорость присоединения тРНК к матрице и образование пептидных связей обуславливается работой большого количества различных ферментов - факторов инициации, элонгации и терминации трансляции. Собственно говоря, вся рибосома представляет собой гигантский катализатор процесса биосинтеза белка. Регуляция биосинтеза происходит путем воздействия на эти ферменты. Ингибирование тех или иных ферментов, осуществляющих биосинтез белка, приводит к остановке биосинтеза - современные молекулярные методы анализа даже позволяют узнать, на какой стадии остановлен процесс и увидеть "застывшую" промежуточную конформацию фермент-субстратного комплекса. Современная модель процесса биосинтеза белка хорошо согласуется с экспериментальными данными, и никаких темных пятен и несостыковок в энергетическом балансе биосинтеза белка нет. Подробнее, если хотите, можете почитать здесь http://www.xumuk.ru/encyklopedia/2/4537.html
Причина, по которой некоторые люди верят в бред клоунов типа Горяева не в том что эти клоуны предагают более логически стройные теории и обьяснения, а из за банальной лени. Физиологически обусловленная экономия энергии головным мозгом, как сказал бы Сергей Савельев)) Критерий истины - проверяемый эксперимент, а у Горяевых в активах только наукообразная словодристика.
Фигасе! Вот это "ножнички".
Автор, а есть-ли броня против такого оружия? Если вы в теме, - расскажите, а...
Щита пока вроде нет.
Но пока и меч полностью не выкован.
Первое печально, второе радует. Э-эх надо жену на эту тему натравить, может чего интересного ещё раскажет.
Благодарю за материал!
Вот после таких материалов и начинаешь осознавать истинную суть выражения:"Многие знания - многие печали"
сдается мне щит от этой технологии в ней же, одни ножницы вставляют, другие специально заточенные на первые - вырезают. это как борьба вирусов/антивирусов, только уже не в компах
Угу, потом пойдут в дело "стелсвирусы", "полиномы" и тд и тп.
Спасибо уважаемый krol_jumarevich . Статья просто прекрасна, давно не получал такого удовольствия. А что касается атакующих организмов то эшерихия это фигня, есть Бацилла Пфейфера, она есть у всех и живет в легких, переносится воздушно капельным путем, так что дивный новый мир стал нам всем немного ближе.
. Статья просто прекрасна, давно не получал такого удовольствия. А что касается атакующих организмов то эшерихия это фигня, есть Бацилла Пфейфера, она есть у всех и живет в легких, переносится воздушно капельным путем, так что дивный новый мир стал нам всем немного ближе.
Однако, считаю что это вопрос дисциплинированного отношения к инструменту, испортить при желании можно все что угодно.
Пожалуйста.
Эшерихии в организме человека больше всего, если считать по массе.
Гы. Только "сверхдоминантность" работает только с диплоидными организмами. А бактерии (включая эшерихий) - гаплоидны, и эти крисперсы там работают сугубо как "иммунитет", включая иммунитет к плазмидам и медленным фагам, которые Вы, в принципе, могли бы, использовать для "горизонтального переноса" нужных Вам признаков.
Да они гаплоидны, но постоянно обмениваются генетической информацией друг с другом с помощью коньюгации, трансдукции, плазмид, и еще каких-то, не помню.
И теоретически этот признак будет передаваться дочерним клеткам в результате деления бактериальной клетки, но и заражать соседей.
Каскадная реакция.
Если есть коньюгация или если шастают медленные фаги "горизонтальный перенос" так и так идёт.
Это понятно.
Горизонтальный перенос - это обобщенное название этого всего: коньюгации, трансдукции, трансформации и т. д.
Ну так то да. Но воздушно-капельно она кажется не переносится)).
Их в кишечнеке целая куча.
Контактным точно переносится, воздушно-капельным не уверен, но предположительно тоже может.
В любом случае, бохх с ней, просто сам по себе метод это действительно революция в генной инженерии и с его помощью можно что угодно и куда угодно прикрутить. А палочек их слава богу по пятачку за пучок, самых разных.
Да ладно... Ничего особо революционного. Векторов типа плазмид, медленных фагов и ретровирусов вполне хватает. Революция, имхо, будет когда будут созданы нормальные Д(Р)НК-сканнеры, которые будут позволять сканировать точно, быстро и без дорогих расходников, и, соответственно, синтезаторы белков и нуклеиновых кислот, которые за минимальную цену будут синтезировать любые цепочки из мономеров.
Т.е. одно дело - ксерить книжки, с ножницами и клеем что-то там редактировать, и совсем другое - отсканировать, распознать, в электронном виде отредактировать, отформатировать, начисто распечатать и переплести.
Вангую, что успех тут ждёт в области металло-протеинов и рибозимов, фиксируемых на кремниевых чипах, в которых, соответственно, располагаются электромагнитные управляющие контуры.
Вот тогда мы охренеем в атаке. То, что биологические вирусы будут писать чаще чем компьютерные, а горожане каждое утро перед выходом из дома будут прививаться, это ещё цветочки. Настоящий трэш и угар начнутся, когда пользователи зальют на Яндекс.Геном (и аналогичные площадки) кучу геномов людей, животных, растений, прочей живности, а количество охлогенетиков превысит количество охлофотографов и охлоблогеров.
Гы, Крол, а Вы сами статью читали?
"Напоследок отметим, что у некоторых фагов найдены гены, способные ингибировать систему CRISPR-Cas, и они также весьма интересны в плане практического применения."
Вы какой-то странный, опять что-то пытаетесь проверять?
Штука прикольная. Создание "сверхдоминантности аллеля" полезно, но не более того.
Создать комара, не способного переносить малярию хорошо, но если его приспособленность будет хуже, чем у дикой породы (а это вполне вероятно), то естественный отбор отсеет и "сверхдоминантный" признак.
Даже если этот новый вид будет менее приспособленным, все равно эти гены с помощью мутагенной цепной реакции будут распространены по всей популяции при условии хоть минимального скрещивания мутантных особей с нормальными.
Как инфекция.
Если выживаемость (до скрещивания) у мутантов в два и более раза хуже чем у диких особей, то они будут потихоньку (или не потихоньку) элиминироваться из популяции. Ещё печальней (для мутантов) ситуация если в размножении принимают участие только самые приспособленные экземпляры или прицельно элиминируются самые неприспособленные.
Если будет сильная эволюционная выбраковка таких мутантных особей, то конечно не взлетит, даже сверхдоминантность не поможет, но насколько выбраковка должна быть сильной нужно проводить расчеты.
А если на выживаемость мутантный ген вообще не будет влиять или влиять минимально, то полная смена генотипа должна произойти очень быстро.
Спасибо за информацию. Вы частенько подкидываете интересные темы ;)
А по теме данная статья самый лучший посыл для создания собственных лабораторий в России. Да и кроме армии и флота никто защиты не даст. А в современном мире, надо исходить из того, что, конечно данная технология будет использована как оружие. Хотя ее нужно использовать и в совершенно противоположном направлении - для увеличения продолжительности жизни например. Хотя я знаю что это расхожий мем :(
Для увеличения жизни и улучшения ее качества - было бы здорово.
Нечто подобное описано у фантастов: Захар Оскотский "Последняя башня Трои". Там либеральный запад уничтожил не угодные ему народы, путем разработки вируса, воздействующего на репродуктивную систему человека. Перед этим активно прививая, якобы от гриппа, собственное население. По сюжету, вторая половина 21 века. После Путина, правительство национального возрождения сменяют опять либералы. Только это спасает народ России от полного истребления.
История знает много примеров реализации фантастических сценариев. Этот будет пострашнее ядерного апокалипсиса. Для проигравшей стороны.
Огромное спасибо за статью!
Страницы